Sistein dioksijenaz - Cysteine dioxygenase - Wikipedia
| Sistein dioksijenaz | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 İnsan CDO (PDB 2IC1'den alınmıştır) | |||||||||
| Tanımlayıcılar | |||||||||
| EC numarası | 1.13.11.20 | ||||||||
| CAS numarası | 37256-59-0 | ||||||||
| Veritabanları | |||||||||
| IntEnz | IntEnz görünümü | ||||||||
| BRENDA | BRENDA girişi | ||||||||
| ExPASy | NiceZyme görünümü | ||||||||
| KEGG | KEGG girişi | ||||||||
| MetaCyc | metabolik yol | ||||||||
| PRIAM | profil | ||||||||
| PDB yapılar | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
| sistein dioksijenaz, tip I | |||||||
|---|---|---|---|---|---|---|---|
| Tanımlayıcılar | |||||||
| Sembol | CDO1 | ||||||
| NCBI geni | 1036 | ||||||
| HGNC | 1795 | ||||||
| OMIM | 603943 | ||||||
| RefSeq | NM_001801 | ||||||
| UniProt | Q16878 | ||||||
| Diğer veri | |||||||
| EC numarası | 1.13.11.20 | ||||||
| Yer yer | Chr. 5 q23.2 | ||||||
| |||||||
Sistein dioksijenaz (CDO) bir değildirhem Demir enzim o katalizler L- dönüşümüsistein -e sistein sülfinik asit (sistein sülfinat). CDO, sistein katabolizmasında önemli bir rol oynar, hücre içi sistein düzeylerini düzenler ve sistein kullanılabilirliğindeki değişikliklere yanıt verir.[1] Bu nedenle, CDO yüksek düzeyde düzenlenir ve konsantrasyon ve verimlilikte büyük değişikliklere uğrar. Aktivasyonu ile sisteini karşılık gelen sülfinik aside okside eder. dioksijen ancak reaksiyonun tam mekanizması hala belirsizdir. CDO, memelilerde bulunmasının yanı sıra, bazı maya ve bakterilerde de mevcuttur, ancak kesin işlevi hala bilinmemektedir.[2][3] CDO, çeşitli nörodejeneratif hastalıklar ve kanserler bu muhtemelen sistein toksisitesiyle ilgilidir.[1][2]
Fonksiyon
CDO, ilk büyük adımdan sorumludur. metabolizma sistein.[4] CDO, sistein sülfinik aside (ağırlıklı olarak anyonik sülfinat formunda bulunan) oksitlenir. in vivo). Genel olarak, CDO, dioksijen (O2)[5] bir tiol, üreten sülfinik asit. Daha spesifik olarak, CDO, oksijeni bir elektron alıcısı olarak kullanan hem-içermeyen demir oksijenazlar grubunun bir parçasıdır. Sistein sülfinik asit daha sonra iki farklı yolla metabolize edilir: dekarboksilat hipotaurin tarafından sülfinoalanin dekarboksilaz ve oksitlendi taurin tarafından hipotaurin dehidrojenaz; veya transamine spontan olarak ayrışan varsayılan bir 3-sülfinilpiruvat ara ürününe piruvat ve sülfit.[1][6] Sülfit daha sonra oksitlenebilir sülfat tarafından sülfit oksidaz.[1] Bu nedenle CDO, hipotaurin / taurin ve sülfit / sülfat üretimi için gereklidir. CDO'nun rolü, esas olarak taurin veya sülfat üretimi için veya sisteinin degradasyonu için kullanılabildiğinden, hücre tipleri arasında değişebilir.[1]

Yapısı
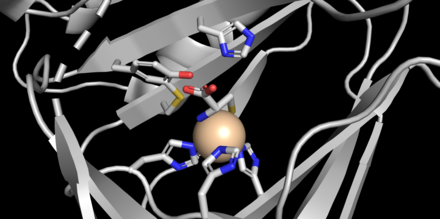
CDO, 22.5 kDa'lık bir proteindir[2] 200 amino asit kalıntısı içeren[3] ve bir izoelektrik nokta (pI) 5.5.[2] Birincil yapı, memeli türleri arasında oldukça korunur, murin ve insan CDO'su yalnızca 16 kalıntıda farklılık gösterir.[3] CDO, cupin üst ailesi,[2] üyeleri 6 iplikli bar-namluya sahip olanlar[8] "jelly-roll" topolojisinde.[3] Proteinin kristal yapıları 1.5 Å çözünürlükte (fare) elde edilmiştir.[1] Aktif bölge, iki histidin ve bir karboksilat yan zincirinin tipik yüz üçlüsü yerine bir demir (II) türüne koordine eden benzersiz bir geometri gösterir,[9] üç histidin ligandı demire bağlanır.[2][3][8] Ayrıca, kristal yapılar, tek bir su molekülüne ek olarak demire koordine edilmiş sisteinin amino nitrojen ve tiolat kükürtünü gösterir (şekle bakın).[2]
CDO, benzersiz bir dahili kofaktör intramoleküler tarafından oluşturulmuştur tiyoeter Cys93 ve Tyr157 arasında, katalize katıldığı kabul edilen oluşum.[1] Protein ilk izole edildiğinde, iki bant agaroz jel gözlemlendi[3] sırasıyla kofaktör içeren proteine ve bağlanmamış "olgunlaşmamış" proteine karşılık gelir. Çapraz bağlanma, CDO'nun verimliliğini on kat arttırır ve substratın aracılık ettiği protein kofaktör oluşumunun alışılmadık bir örneği olan sistein seviyeleri tarafından düzenlenir (ileri besleme aktivasyonu).[1]
Mekanizma
CDO mekanizması, reaksiyonun ayrıntılarını aydınlatmak için yapılan aktif araştırmalara rağmen hala tam olarak anlaşılmamıştır.[2] Genel olarak, reaksiyon O'nun eklenmesini içerir2 enzim katalizi olmaksızın kendiliğinden oluşan sistein.[3] Çalışmalar, sisteiniltirozin köprüsünün tirozinin oksidasyon potansiyelini düşürdüğünü göstermiştir (genellikle bir elektron donörü, fotosistem II ) fenole göre ~ 0.5 V oranında ve asitliğini arttırır.[2] Tiyoeter kısmı muhtemelen yapısal, redoks veya asit / baz rolü oynar. Diğer çalışmalar, Tyr157'nin enzim işlevi için (muhtemelen bir tirozinil radikali olarak) gerekli olduğunu ve CDO varyantları arasında yüksek oranda korunduğunu göstermiştir.[2] Ayrıca, araştırmalar göstermiştir ki sisteamin yapısal olarak sisteine benzer bir molekül olan, sistein oksidasyonunu arttırır, ancak bir substrat değildir.[2][6]
Hesaplamalı ve spektroskopik çalışmalarla desteklenen önerilen bir mekanizma, O2 bağlayıcı cis reaktif demir (III) oluşturmak için bir tiyolata -süper okso Türler (Bir), daha sonra dört üyeli bir halka yapısı oluşturmak için sisteinin bağlı kükürtüne saldırır (B).[10][11][12] Heterolitik O-O bağı bölünmesi daha sonra bir yüksek değerli demir (IV) okso orta (C), ikinci oksijeni sülfüre aktarır.[10][11]
Yönetmelik
CDO, sistein homeostazını sürdürmek için hücrede sıkı bir şekilde düzenlenir. Özellikle, CDO, sitotoksisiteyi önlemek için düşük sistein seviyeleriyle azalmış aktiviteyi ve yüksek seviyelerde artan aktiviteyi koruyarak diyette sistein bulunurluğu ve protein alımındaki değişikliklere yanıt verir.[1] Çalışmalar, CDO'nun saatler içinde hepatik aktivitede dramatik bir artış sergileyebileceğini göstermiştir. Pek çok enzimin aksine, ağırlıklı olarak transkripsiyonelden (mRNA seviyeleri) ziyade protein dönüşü seviyesinde düzenlenir. Yüksek sistein seviyeleri inhibe eder ubikitinilasyon oranını düşüren proteazomal bozulma.[1] CDO ayrıca yüksek sistein seviyelerinin artmış hipotaurin / taurin üretimine neden olduğu yağ dokusunda da düzenlenir.[1] CDO'nun düzenlenmesinin aynı zamanda proteinin hem çapraz bağlı hem de olgunlaşmamış formlarını içerdiği düşünülmektedir.
Hastalık İlişkisi
Sistein metabolizmasıyla ilgisi nedeniyle, CDO aktivitesindeki değişiklikler insanlarda hastalığa neden olabilir. Araştırmalar, yüksek sistein yapabileceğini bulmuştur. sitotoksik, nörotoksik,[1] ve eksitotoksik.[2] Anormal veya yetersiz CDO aktivitesi ile bağlantılı Alzheimer hastalığı, Parkinson hastalığı, romatizmal eklem iltihabı,[13] ve motor nöron hastalıkları.[1][2][14] Bu hastalıklarda, hastalar düşük sülfat seviyeleri, yüksek açlık sistein plazma konsantrasyonları ve bozulmuş sistein oksidasyonu ile uyumlu diğer semptomlar sergiler.[1] CDO eksikliği ve ardından sistein birikimi Globus pallidus ile bağlantılı Hallervorden-Spatz hastalığı.[15]
CDO'nun ekspresyonu kanser hücrelerinde değişir[2] ve metilasyonu CDO1 (insan sistein dioksijenaz tip I) promoter geninin kolon, meme, yemek borusu, akciğer, mesane ve mide kanserlerinde ortaya çıktığı gösterilmiştir.[16] CDO1'in susturulması meme kanserinde kritik bir epigenetik olaydır ve CDO1 aktivitesinin aşağı regülasyonuna yol açar.[16][17] Özellikle, azalmış CDO1 aktivitesi, hidrojen sülfit (H2S) çeşitli hastalıklara bağlanmıştır.[16] Bu sonuçlar, CDO1'in (insan sistein dioksijenaz tip I) bir tümör baskılayıcı gen ve potansiyel olarak kanser için bir biyobelirteç görevi görebilir.[16]
Referanslar
- ^ a b c d e f g h ben j k l m n Stipanuk MH, Ueki I, Dominy JE, Simmons CR, Hirschberger LL (Mayıs 2009). "Sistein dioksijenaz: hücresel sistein seviyelerinin düzenlenmesi için sağlam bir sistem". Amino asitler. 37 (1): 55–63. doi:10.1007 / s00726-008-0202-y. PMC 2736881. PMID 19011731.
- ^ a b c d e f g h ben j k l m n Joseph CA, Maroney MJ (Ağustos 2007). "Sistein dioksijenaz: yapı ve mekanizma". Kimyasal İletişim. 0 (32): 3338–49. doi:10.1039 / B702158E. PMID 18019494.
- ^ a b c d e f g Stipanuk MH, Simmons CR, Karplus PA, Dominy JE (Haziran 2011). "Tiyol dioksijenazlar: benzersiz cupin protein aileleri". Amino asitler. 41 (1): 91–102. doi:10.1007 / s00726-010-0518-2. PMC 3136866. PMID 20195658.
- ^ Chai SC, Jerkins AA, Banik JJ, Shalev I, Pinkham JL, Uden PC, Maroney MJ (Mart 2005). "Rekombinant sıçan sistein dioksijenazının heterolog ekspresyonu, saflaştırılması ve karakterizasyonu". Biyolojik Kimya Dergisi. 280 (11): 9865–9. doi:10.1074 / jbc.M413733200. PMID 15623508.
- ^ Lombardini JB, Singer TP, Boyer PD (Mart 1969). "Sistein oksijenaz. II. 18oksijen ile reaksiyonun mekanizması üzerine çalışmalar". Biyolojik Kimya Dergisi. 244 (5): 1172–5. PMID 5767301.
- ^ a b Sakakibara S, Yamaguchi K, Hosokawa Y, Kohashi N, Ueda I (Şubat 1976). "Sıçan karaciğer sistein oksidazının (sistein dioksijenaz) saflaştırılması ve bazı özellikleri". Biochimica et Biophysica Açta (BBA) - Enzimoloji. 422 (2): 273–9. doi:10.1016/0005-2744(76)90138-8. PMID 2307.
- ^ Ye S, Wu X, Wei L, Tang D, Sun P, Bartlam M, Rao Z (Şubat 2007). "İnsan sistein dioksijenaz mekanizmasına ilişkin bir fikir. Tiyoeter bağlı tirozin-sistein kofaktörünün anahtar rolleri". Biyolojik Kimya Dergisi. 282 (5): 3391–402. doi:10.1074 / jbc.M609337200. PMID 17135237.
- ^ a b McCoy JG, Bailey LJ, Bitto E, Bingman CA, Aceti DJ, Fox BG, Phillips GN (Şubat 2006). "Fare sistein dioksijenazının yapısı ve mekanizması". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 103 (9): 3084–9. doi:10.1073 / pnas.0509262103. PMC 1413891. PMID 16492780.
- ^ Gardner JD, Pierce BS, Fox BG, Brunold TC (Temmuz 2010). "Substrata bağlı fare sistein dioksijenazının spektroskopik ve hesaplamalı karakterizasyonu: demirli ve ferrik sistein eklentilerinin doğası ve mekanik çıkarımlar". Biyokimya. 49 (29): 6033–41. doi:10.1021 / bi100189h. PMC 2914100. PMID 20397631.
- ^ a b c Tchesnokov EP, Faponle AS, Davies CG, Quesne MG, Turner R, Fellner M, Souness RJ, Wilbanks SM, de Visser SP, Jameson GN (Temmuz 2016). "Sistein dioksijenazın katalitik döngüsü sırasında oluşan bir demir-oksijen ara maddesi". Kimyasal İletişim. 52 (57): 8814–7. doi:10.1039 / C6CC03904A. PMC 5043143. PMID 27297454.
- ^ a b c Villar-Acevedo G, Lugo-Mas P, Blakely MN, Rees JA, Ganas AS, Hanada EM, Kaminsky W, Kovacs JA (Ocak 2017). "Bir Fe (III) Tiyolata Metal Destekli Okso Atom Eklenmesi". Amerikan Kimya Derneği Dergisi. 139 (1): 119–129. doi:10.1021 / jacs.6b03512. PMC 5262503. PMID 28033001.
- ^ Kumar D, Thiel W, de Visser SP (Mart 2011). "Sistein dioksijenaz enzimlerinde oksijen aktivasyon işleminin mekanizması üzerine teorik çalışma". Amerikan Kimya Derneği Dergisi. 133 (11): 3869–82. doi:10.1021 / ja107514f. PMID 21344861.
- ^ Emery P, Bradley H, Arthur V, Tunn E, Waring R (Temmuz 1992). "Erken artritin sonucunu etkileyen genetik faktörler - sülfoksidasyon durumunun rolü". İngiliz Romatoloji Dergisi. 31 (7): 449–51. doi:10.1093 / romatoloji / 31.7.449. PMID 1628166.
- ^ Heafield MT, Fearn S, Steventon GB, Waring RH, Williams AC, Sturman SG (Mart 1990). "Motor nöron, Parkinson ve Alzheimer hastalığı olan hastalarda plazma sistein ve sülfat seviyeleri". Sinirbilim Mektupları. 110 (1–2): 216–20. doi:10.1016 / 0304-3940 (90) 90814-p. PMID 2325885. S2CID 26672064.
- ^ Perry TL, Norman MG, Yong VW, Whiting S, Crichton JU, Hansen S, Kish SJ (Ekim 1985). "Hallervorden-Spatz hastalığı: globus pallidusta sistein birikimi ve sistein dioksijenaz eksikliği". Nöroloji Yıllıkları. 18 (4): 482–9. doi:10.1002 / ana.410180411. PMID 4073841. S2CID 364798.
- ^ a b c d Brait M, Ling S, Nagpal JK, Chang X, Park HL, Lee J, ve diğerleri. (Eylül 2012). "Sistein dioksijenaz 1, birçok insan kanserinde promoter metilasyonu ile susturulmuş bir tümör baskılayıcı gendir". PLOS ONE. 7 (9): e44951. doi:10.1371 / journal.pone.0044951. PMC 3459978. PMID 23028699.
- ^ Jeschke J, O'Hagan HM, Zhang W, Vatapalli R, Calmon MF, Danilova L, ve diğerleri. (Haziran 2013). "Sistein dioksijenaz tip 1'in sık sık inaktivasyonu, meme kanseri hücrelerinin hayatta kalmasına ve antrasiklinlere dirence katkıda bulunur". Klinik Kanser Araştırmaları. 19 (12): 3201–11. doi:10.1158 / 1078-0432.CCR-12-3751. PMC 3985391. PMID 23630167.
Dış bağlantılar
- CDO1 insan gen konumu UCSC Genom Tarayıcısı.
- CDO1 insan geni ayrıntıları UCSC Genom Tarayıcısı.

